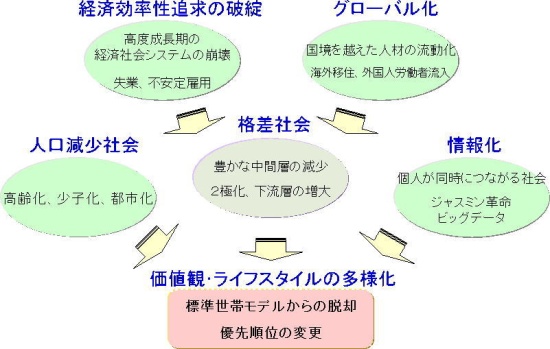
水平化効果(すいへいかこうか、英: leveling effect)とは、溶媒に強い酸および強い塩基を加えてもその強さが溶媒によって決定され、見かけ上強さの差が隠される現象のことである。
反応プロセス
溶媒分子を、プロトンを明らかにしてHSolと書くと、ある酸HAがこの溶媒HSolより十分強ければ溶媒にプロトンを渡して解離する。
HA HSol → A− H2Sol
同様に、塩基Bが溶媒HSolより十分強ければ溶媒からプロトンを奪う。
B HSol → HB Sol−
したがって、溶液中で最も強い酸(プロトン供与体)は溶媒の共役酸であり、最も強い塩基(プロトン受容体)は溶媒の共役塩基である。
分別滴定
水中では、塩酸 (HCl) は十分に強い酸であるから、以下のように完全解離する。
HCl H2O → Cl− H3O
過塩素酸 (HClO4) も同様に十分に強いので、完全解離する。
HClO4 H2O → ClO4− H3O
したがって、塩酸と過塩素酸の酸の強さは水溶液中では区別することができない。しかしながら、塩基性(プロトン受容性)の弱い溶媒中、あるいはプロトン授受に不活性な溶媒中で滴定すると、これらを分別することができる。例えば、この2つの酸をメチルイソブチルケトン (MIBK) 中で水酸化テトラブチルアンモニウム (Bu4NOH) で滴定すると、先に過塩素酸が中和され、
HClO4 Bu4NOH → Bu4N・ClO4 H2O
過塩素酸の中和が完了したのちに、塩酸が中和される。
HCl Bt4NOH → Bu4N・Cl H2O
関連項目
- 酸と塩基
- 自己解離